細胞に取り込まれた分子を選別する細胞内小器官エンドソームの新しい形成メカニズムの発見
〜ゴルジ体によるエンドソーム形成の制御機構を解明〜

東京工科大学医療保健学部 十島純子教授と東京理科大学基礎工学部生物工学科 長野真助教、十島二朗教授らの研究チームは、細胞が外部から物質を取り込む現象であるエンドサイトーシスについて、新しいメカニズムを発見しました。エンドサイトーシスは真核生物の細胞に普遍的に備わる機能であり、細胞による外部から栄養物質の取り込み、神経伝達物質の放出サイクル、免疫応答反応等、様々な生命現象において非常に重要です。また、エンドサイトーシスは細胞のがん化にも深く関わっています。このため、本研究で明らかにされた新しい細胞のエンドサイトーシス機構は、様々な基本的な生命現象の分子機構のみならず、エンドサイトーシス異常が原因となる疾患の基本メカニズムの解明につながることも期待されます。尚、本研究成果は、ダリア・シークハウス教授(IST、オーストリア)らとの共同研究によるものです。
* 本研究成果は本日(現地時間、令和元年11月15日)の生命科学雑誌「Communications Biology」(オンライン版)に掲載されました。
<原論文情報>
雑誌名 :Communications Biology, DOI: 10.1038/s42003-019-0670-5, 2019)
論文タイトル:Rab5-mediated endosome formation is regulated at the trans-Golgi network.
著者 :Makoto Nagano1, Junko Y. Toshima2, 4, Daria Elisabeth Siekhaus3, and Jiro Toshima1, 4 (1東京理科大学基礎工学部, 2東京工科大学医療保健学部, 3Institute of Science and Technology Austria, 4Corresponding authors)
【研究の背景】
ヒトを含むすべての生物の体の最小単位は細胞であり、栄養の摂取、エネルギーの産生、老廃物の処理などをはじめとする、ほとんどの生命現象は細胞単位で行われています。また、病原ウィルスが感染し、死滅させてしまうのも細胞であり、異常に増殖して「がん」を作るのも細胞です。このため、細胞のはたらきが生命活動そのものであるといっても過言ではありません。エンドサイトーシスは私達の体の中の多くの細胞に備わる非常に基本的な生命現象であり、細胞が外部から栄養物質や、細胞機能を維持するための情報分子を取り込む機構です(図1)。
細胞がこれら外部の物質(栄養、情報分子、病原ウィルスなど)を取り込むと、それらはまず細胞内に存在するエンドソームに送られた後、リソソームと呼ばれる細胞内小器官で分解されるか、もしくは細胞膜へとリサイクルされます(図1)。細胞が外部から取り込む物の中には、病原ウィルスも含まれており、エンドサイトーシスにより細胞内に取り込まれたウィルスはエンドソームから細胞内へと侵入し、様々な病気を引き起こします。このように、エンドソームは細胞外から取り込まれた分子の行き先を決める重要な細胞内小器官であり、エンドソーム形成の分子メカニズムを明らかにすることは、細胞が外部の物質を取り込む仕組みを理解する上で非常に重要であると考えられます。
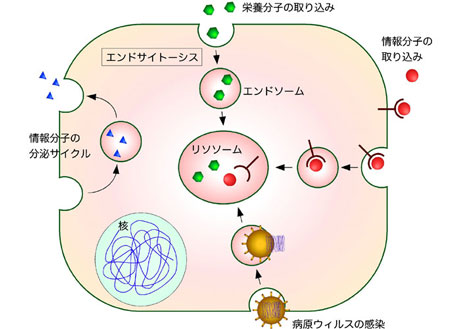
図1. 細胞におけるエンドサイトーシスの役割
十島(純)教授と十島(二)教授らは以前の研究において、出芽酵母のエンドサイトーシス過程を可視化することのできる新規の蛍光分子マーカーの開発に成功し、これを用いてエンドサイトーシス経路におけるエンドソームの形成・成熟には細胞膜から形成されるエンドサイトーシス小胞とゴルジ体から輸送される小胞の融合が重要であることを発見しました(Nature communications, 2014)。今回、本研究グループの長野真助教らは、従来、細胞膜から作られるエンドサイトーシス小胞の融合により形成されると考えられていたエンドソームが、ゴルジ体で作られる輸送小胞から形成されることを明らかにしました。
【研究成果の概要】
長野助教らは、エンドソームの形成機構を明らかにするため、まずエンドサイトーシスを薬剤、もしくは遺伝子変異により停止させた細胞を用いて、エンドソーム形成への影響を調べました。この結果、これらのエンドサイトーシス小胞が正常に形成されない細胞においても、エンドソームは正常に形成されることを見出しました。これ対して、薬剤によりゴルジ体の機能を抑制した細胞においては、エンドソームの形成が著しく損なわれることを明らかにしました。また、ゴルジ体からの小胞輸送の効率が低下している変異体を用いて、同様の実験を行った場合でもエンドソーム形成に顕著な異常が生じることを明らかにしました。さらに、エンドソーム形成の鍵因子であるRab5タンパク質の機能がゴルジ体に局在する活性化因子により制御されていることを見出しました。これらの発見は、エンドソームの形成には、細胞膜から形成されるエンドサイトーシス小胞よりも、ゴルジ体から形成された小胞の方がより重要であることを示唆しています。このため、エンドサイトーシス経路はゴルジ体からリソソームへと向かう輸送経路を一部利用していると考えられます(図2)。このモデルは「エンドソームはエンドサイトーシスにより形成された小胞から作られる」といった従来のモデルとは異なるものであり、これまで不明であった様々な問題を解く重要な鍵となる可能性があります。
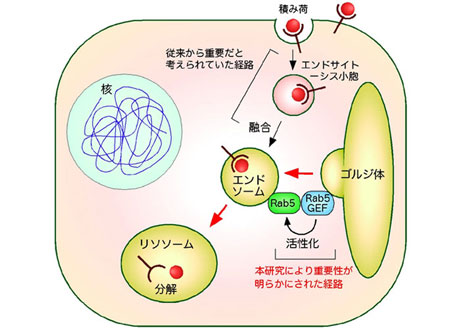
図2. ゴルジ体によるエンドソーム形成の制御
【今後の展望】
エンドソームは病原ウィルスの感染経路であるほか、がん細胞等の細胞増殖制御においても重要な役割を果たしています。このため、エンドソームの形成メカニズムの解明はこれら人間の疾患の基本メカニズムの解明や新しい治療法開発の基盤となることが期待されます。本研究では、従来からの考えとは大きく異なる、ゴルジ体によるエンドソーム形成の制御メカニズムの一端を明らかにしましたが、その詳細なメカニズムについては分かっていません。今後は、この全く新しいエンドソーム形成の分子機構の詳細について明らかにする必要があります。
 本研究内容に関するお問合せ先
本研究内容に関するお問合せ先
■東京工科大学 医療保健学部 教授 十島純子
Tel:03-6424-2111 (内線5205)
e-mail:toshimajk(at)stf.teu.ac.jp
※(at)はアットマークに置き換えてください。
 当プレスリリースの担当事務局
当プレスリリースの担当事務局
■学校法人片柳学園 出版部 担当: 大田
〒192-0982 東京都八王子市片倉町1404-1
Tel:042-637-2109
E-mail: ohta(at)stf.teu.ac.jp
※(at)はアットマークに置き換えてください。


