副作用の少ないバイオ医薬品の血中安定性の向上技術に進展---汎用性とコストに優れた大腸菌による製造手法を確立
東京工科大学(東京都八王子市、学長:大山恭弘)応用生物学部の佐藤淳教授らの研究グループは、副作用リスクの少ないバイオ医薬品の血中安定性の向上手法として期待される、IgG Fc融合タンパク質の技術について、より汎用性やコストに優れた大腸菌による製造手法を確立しました。
本研究成果は、日本薬学会の学会誌「Biological and Pharmaceutical Bulletin」3月号に掲載されました(注1)。
【研究背景】
IgG Fc融合技術(注2)は、バイオ医薬品と抗体の一部であるIgGのFc領域を融合させる技術で、血中安定性を向上させることを目的としています。同研究グルーブでは、細胞傷害性(注3)による副作用を引き起こす免疫エフェクター機能を示さない「ヒンジ欠失型」CH2-CH3融合技術の開発に成功しています(図1、Shiga, Y. et al., 14, 3025-3035, (2017) Mol Pharm)。一般的にバイオ医薬品の製造には、CHO細胞など動物細胞が使用されますが、この製造に大腸菌を使用することができれば、手間やコストの軽減につながります。本研究では、「ヒンジ欠失型」CH2-CH3タンパク質の大腸菌での製造について検証を行いました。
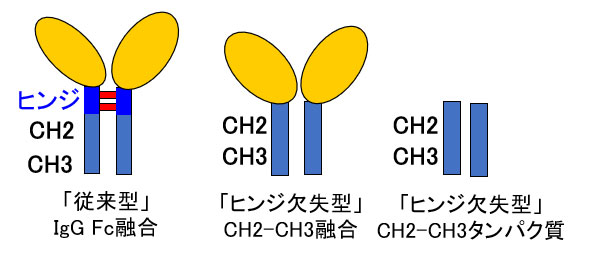
[図1] 「ヒンジ欠失型」CH-2CH-3融合
【研究成果】
製造に大腸菌を用いた場合、タンパク質はしばしば立体構造が正しく形成されない、いわゆる封入体として生産されます。この場合、封入体を界面活性剤などの変性剤で一旦溶解させ(可溶化)、その後変性剤を除去しながら、正しい構造を持つタンパク質を調製する必要があります(巻き戻し)。実際、大腸菌で生産されるバイオ医薬品の多くは、この可溶化、巻き戻しのステップを経て生産されていますが、すべてのバイオ医薬品に適応可能な方法はなく、バイオ医薬品ごとに最適な可溶化、巻き戻し条件を見つける必要があります。本研究では、封入体を形成する「ヒンジ欠失型」CH2-CH3
タンパク質に対して、効率的な可溶化方法を検討致しました。その結果、可溶化する際のpHをアルカリ性にすると(図2上段)、中性の場合(図2下段)と比較して、「ヒンジ欠失型」CH2-CH3タンパク質が正しい立体構造を示すことを見出しました。これらの結果から、「ヒンジ欠失型」CH2-CH3融合技術が、従来の動物細胞だけではなく、大腸菌での生産にも適用できる可能性が示されました。
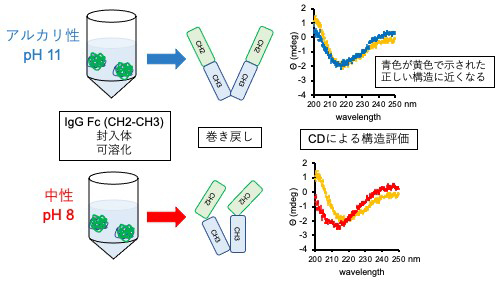
[図2] アルカリ性での可溶化は、CH2-CH3の正しい構造巻き戻しをもたらす
【社会的・学術的なポイント】
副作用リスクの少ないバイオ医薬品の血中安定性の向上手法である「ヒンジ欠失型」CH2-CH3融合技術に関して、簡便性やコストに優れた大腸菌生産に適用する方法を示しました。この報告により、その汎用性が高まるものと期待されます。
(注1) 論文名「Show Ishikawa, Haruna Ishikawa and Atsushi Sato, Improved Refolding of a Human IgG1 Fc (CH2-CH3) Scaffold from Its Inclusion Body in E. coli by Alkaline Solubilization, 45, p.284-291, (2022) Biol Pharm Bull」
(注2) IgG Fc:IgGとは免疫で機能する分子であり、体内に侵入してきた外敵に結合して、排除する機能を持つ。Fcはその配列の一部であり、ヒンジ、CH2、CH3の各領域から構成される。
(注3) 免疫エフェクター機能による細胞傷害性:細胞表面に結合したIgGのFcと、NK細胞や好中球、補体が結合することで引き起こされる細胞の除去機構。抗体制癌剤の癌細胞の除去機構で利用されている。
■東京工科大学応用生物学部 佐藤淳(⽣物創薬)研究室
遺伝子組換え、生化学、細胞培養技術を基盤とした生物創薬に関する研究を行っている。
工学的な発想で、創薬という「モノ作り」を推進している
[主な研究テーマ]
1. 自然免疫で機能する多機能性タンパク質であるラクトフェリンの機能解析(特に抗腫瘍作用)
2. 体内安定性を高めたラクトフェリンのバイオ医薬品としての開発
3. 疾患に関連する糖鎖を標的とするバイオ医薬品の開発
4. ファージディスプレイ法を用いた新規機能ペプチドの創製
5. 体外循環モジュールを用いる新しい治療法の開発
■応用生物学部WEB:
https://www.teu.ac.jp/gakubu/bionics/index.html


