抗がん剤による細胞死の違いを「物理的変化」から可視化 ― 水晶振動子センサーで抗がん剤の作用機構の違いを解明 ―
東京工科大学(東京都八王子市、学長:香川豊)大学院バイオ情報メディア研究科バイオニクス専攻の龍昊さん、杉山友康教授、村松宏名誉教授の研究グループは、がん化学療法で併用される抗がん剤マイトマイシンCと5-フルオロウラシルの効果について、そのがん細胞死の過程の違いを水晶振動子を用いた生物物理的解析によって明らかにしました。
本研究成果は、2025年12月22日に学術誌「Journal of Biological Physics」オンライン版に掲載されました。
【発表のポイント】
・水晶振動子マイクロバランス(QCM)を用いて、抗がん剤処理中の細胞の物理的変化をリアルタイムで計測
・マイトマイシンC(MMC)と5-フルオロウラシル(5-FU)で、細胞死に至る過程が明確に異なることを発見
・QCMは従来の生存率評価を補完する新たな抗がん剤評価手法として期待される
【研究の背景】
抗がん剤はがん細胞を死滅させる一方で、その作用機構は薬剤ごとに大きく異なる。異なる抗がん剤を組み合わせたがん治療法は、さまざまな種類の癌で予後が良好なことが知られている。その説明としてこれまで、薬剤の効果は主に細胞の生存率や分子マーカーを用いて評価されてきたが、細胞が死に至る過程で起こる「形態」や「物理的性質」の変化については十分に解析されてこなかった。
QCMは電極表面に付着した細胞の質量や粘弾性の変化を、共振周波数の変化として高感度に検出できる技術である(図1)。本研究ではQCMと蛍光顕微鏡を組み合わせることで、抗がん剤処理中の細胞の物理的変化と細胞死を同時に観察し、薬剤ごとの細胞応答の違いを明らかにすることを目的とした。
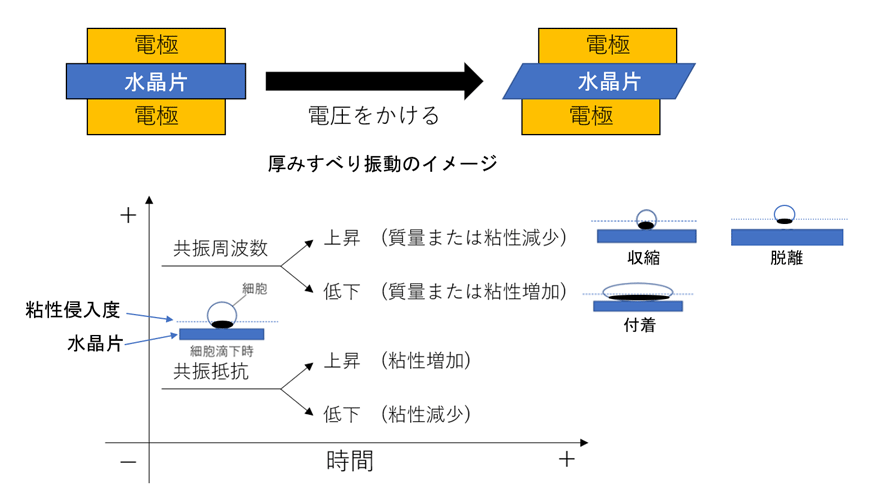
【研究の内容】
研究チームは、ヒト肝がん由来細胞(HepG2)を対象に、DNA架橋形成を引き起こすMMCと、DNA・RNA合成を阻害する5-FUを投与し、QCMによる共振周波数変化と細胞死の進行を同時に測定した。その結果、MMC処理では薬剤添加後まもなく共振周波数が急激に変化し、その後に細胞死が遅れて起こることが分かった。一方、5-FU処理では共振周波数の変化は小さく、比較的短い遅延の後に細胞死が観察された。
さらに、測定データを応答モデルに当てはめて解析したところ、両薬剤で得られるパラメータが明確に異なり、細胞死に至る物理的プロセスが本質的に異なることが示された。これによりQCMは単なる生死判定では捉えられない、抗がん剤特有の細胞応答を検出できることが明らかになった(図2)。
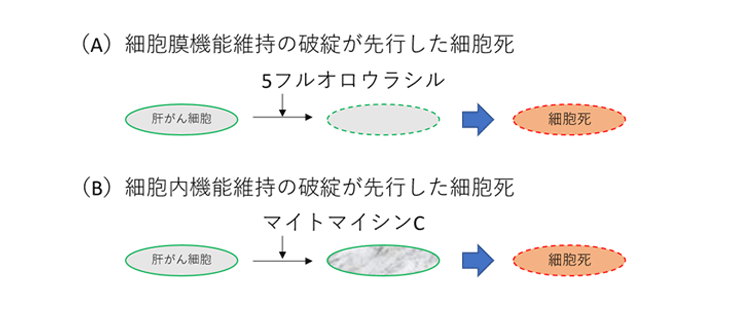
【社会的意義・今後の展望】
本研究は、抗がん剤の効果を「細胞の物理的性質」という新しい視点から評価できる可能性を示している。QCMを用いることで、細胞が死に至る前段階の変化をリアルタイムで捉えることができ、抗がん剤の作用機構の理解や新規薬剤のスクリーニングに役立つと期待される。
将来的には、分子生物学的解析と組み合わせることで、薬剤併用療法の最適化や、副作用の少ない治療法の開発につながることが期待される。
【論文情報】
論文名:Difference in cell death response between mitomycin C and 5-Fluorouracil treatment studied using quartz crystal microbalance combined with simultaneous monitoring of viable cells
雑誌名:Journal of Biological Physics
URL:https://doi.org/10.1007/s10867-025-09695-5
■応用生物学部WEB:
https://www.teu.ac.jp/gakubu/bionics/index.html


